澳門大學健康科學學院教授袁振帶領的團隊研發出一種能有效治療腦膜炎的新藥物。相關研究成果已在《科學進展》(Science Advances)期刊上發表,引起了生物學和腦科學領域的廣泛關注。
由於過度使用抗生素,多重耐藥細菌的出現和廣泛傳播對公共衛生構成巨大挑戰。在這些多重耐藥細菌中,有些已被世界衛生組織(WHO)列為需優先關注的ESKAPE病原體,特別是多重耐藥鮑曼不動桿菌(Acinetobacter baumannii)。目前,用於治療鮑曼不動桿菌感染的抗生素有限,並已出現對替加環素和粘菌素的耐藥菌株,而這類抗生素的副作用如腎毒性等不容忽視,迫切需要開發新型抗生素來應對這一問題,因此最近的研究重點是開發金屬絡合物作為抗多重耐藥菌的新型抗菌劑。金屬複合物以一個或多個金屬中心為中心,在多個配體的促進下形成高度多樣化的三維結構,展現出更有效的滅菌效率、更高的靶向性和更低的耐藥性。
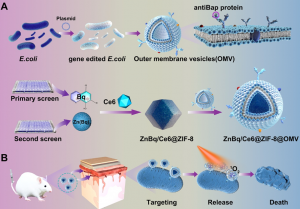
為了消除多重耐藥細菌鮑曼不動桿菌,研究團隊對1,100多種FDA批准的生物活性小分子藥物進行了全面篩選,並探究了broxyquinoline(Bq)與各種金屬離子聯合使用的療效。在測試的所有化合物中,研究團隊發現了一種名為Zn(Bq)2的金屬絡合物,它被確定為一種非凡的候選物,對鮑曼不動桿菌展現出約0.21μg/mL的超低最小抑制濃度。
高效的抗菌金屬配合物通常具有疏水性,這可能會限制它們的功效。此外,活性極高的金屬配合物在接觸到不同的生物環境時可能發生配體交換反應。為了克服這些局限並確保藥物的靶向輸送和作用,研究團隊發展了一系列創新的方法。首先,通過基因工程改造了具有選擇性靶向鮑曼不動桿菌能力的外膜囊泡(OMV)。這些OMV充當載體,能將抗菌金屬配合物直接輸送到目標細菌,從而提高其抗菌效能。其次,團隊採用了納米沸石咪唑骨架-8(ZIF-8)作為藥物載體平台,ZIF-8框架允許高效裝載並傳輸強效抗菌金屬配合物Zn(Bq)2。通過運用ZIF-8,他們提高了金屬配合物的穩定性和生物利用度,並確保其高效抵達目標細菌。通過這些綜合策略,研究團隊成功實現了對鮑曼不動桿菌高達99.9999999%的滅活。研究團隊還建立了鮑曼不動桿菌誘發腦膜炎的小鼠模型,並進行了活體實驗。他們利用構建的藥物治癒了由鮑曼不動桿菌引發的腦膜炎,突顯了該藥物在治療細菌感染,尤其是那些難以根除的感染方面的可能性。
這項研究不僅解決了傳統抗生素對鮑曼不動桿菌的限制,還提供了一種靶向策略,由基因工程OMV提供,代表了靶向滅菌領域的重大進步。該抗生素能夠有效消除多重耐藥細菌而不會引起耐藥性,並有助於應對日益嚴重的抗生素耐藥性的全球威脅,代表了非傳統抗生素開發的重大進展。
是次研究的通訊作者為袁振教授,其博士生韋憲圓和前博士後薛彬為共同第一作者。深圳理工大學教授阮雙琛也對這項研究提供了資金支持。該項目由澳門特別行政區科學技術發展基金(檔案編號:0020/2019/AMJ和0048/2021/AGJ)和澳門大學(檔案編號:MYRG2020-00067-FHS、MYRG2019-00082-FHS、MYRG2022-00054-FHS和MYRG-GRG2023-00038-FHS-UMDF)資助。研究文章的完整版本可瀏覽https://www.science.org/doi/10.1126/sciadv.adk6331。
| 新聞來源:健康科學學院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 8822 8004 |
| 庄瑜婷 | 電話:(853) 8822 4323 |
| 電郵: | prs.media@um.edu.mo |