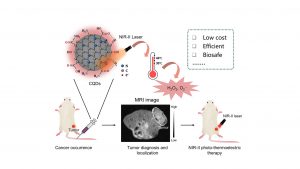
澳門大學應用物理及材料工程研究院講座教授湯子康、特聘教授孫漢東的研究團隊聯合健康科學學院講座教授鄧初夏的研究團隊,開發一種高電子自旋和光學弛豫的碳量子點,該碳點在生物環境中展現出卓越的磁共振成像(MRI)能力及近紅外二區(NIR-II)光驅動的熱電催化性能,因此建立一種MRI引導的NIR-II精準光療新策略。相關研究成果已發表於國際知名期刊《自然通訊》。
碳量子點是納米醫學領域的新興候選藥物,表現出與電子自旋、弛豫和遷移相關的有趣行為,在具備較高的腫瘤靶向能力、有效的腫瘤殺傷效果、治療持續時間短、對身體的副作用小等優點的精準癌症治療中,非金屬碳點因其優異的生物相容性和低細胞毒性而受到青睞,將治療功能與MRI元件相結合是碳點臨床應用中具備潛力的目標。在目前報導的MRI造影劑中,Gd基造影劑的毒性、有機小分子造影劑的低弛豫性和穩定性限制了它們的臨床應用。因此,開發高弛豫性碳基造影劑(如非金屬碳點)至關重要。然而,使用非金屬CQDs在NIR-II視窗中實現光療或MRI挑戰性極高。研究團隊已於過往研究中,通過極化子工程解決碳點在NIR-II吸收係數和光學轉換效率低的難題,相關研究成果亦已發表於國際知名期刊《科學進展》,全文請瀏覽:https://www.science.org/doi/10.1126/sciadv.adn7896。
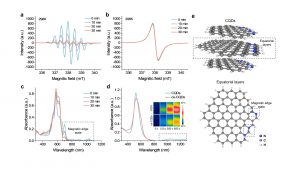
是次研究則致力引入碳點的磁邊緣態,同時實現MRI和NIR-II癌症治療,顯示出精準癌症治療的潛力。為此,研究團隊通過自由基聚合法合成高順磁性碳量子點,通過電子順磁共振波譜及瞬態吸收光譜,證實其室溫下存在邊緣氮核間快速的電子自旋和光學弛豫。通過調控磁性邊緣態電子弛豫與遷移行為,碳點展現出卓越的MRI T₁成像能力(r₁=270 mM⁻¹s⁻¹)及NIR-II光熱電催化性能。結合蛋白冠介導的腫瘤被動靶向特性,實現了MRI引導的NIR-II精準腫瘤治療。在量子技術背景下,該工作突破碳基材料自旋調控瓶頸,通過結構—配體—環境協同調控,實現超越金屬材料的電子弛豫和遷移特性,為碳基材料在高效自旋平均化、超精細分裂及零場分裂的研究提供新範式,推動納米醫學與自旋電子學發展。
該研究通訊作者為湯子康、鄧初夏、孫漢東和澳大應用物理及材料工程研究院研究助理張特森,第一作者為張特森。該研究由澳門特別行政區科學技術發展基金(檔案編號:0128/2020/A3、0131/2020/A3、0007/2021/AKP、006/2022/ALC、0139/2022/A3)、澳門大學(檔案編號:CPG2020-00026-IAPME、CPG2021-00034-IAPME、CPG2022-00013-IAPME、CPG2025-00034-IAPME、SRG2023-00025-IAPME、MYRG2020-00164-IAPME)、廣東省科學技術廳(檔案編號:2022A0505030024)、深港澳科技計劃項目(C類)(檔案編號:SGDX20210823103803021)、粵港澳光熱電能源材料與器件聯合實驗室(檔案編號:EF010/IAPME-TZK/2020/GDSTC)資助。全文可瀏覽:https://www.nature.com/articles/s41467-025-60951-7。
| 新聞來源:應用物理及材料工程研究院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 88228004 |
| 梁曉珊 | 電話:(853) 88228009 |
| 電郵: | prs.media@um.edu.mo |