澳門大學健康科學學院講座教授沈漢明帶領的研究團隊揭示了TGFβ-SMAD信號通路中的關鍵效應因子SMAD3調控PINK1轉錄方面的新機制,對闡明PINK1在帕金森病等神經退行性疾病中的病理功能具有重要的理論價值。相關研究成果已刊登於國際知名期刊《細胞發現》。
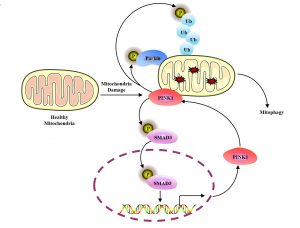
線粒體自噬是一種選擇性自噬,作為線粒體品質控制的核心機制,通過自噬-溶酶體途徑選擇性清除受損線粒體,從而維持線粒體穩態。PINK1-Parkin通路是線粒體自噬重要的調控分子機制,當線粒體受損時,PINK1蛋白穩定在線粒體外膜並通過自磷酸化啟動,進而通過磷酸化泛素(Ub)和招募E3泛素連接酶Parkin形成正回饋環路,持續放大線粒體自噬信號。近年來關於PINK1-Parkin下游的調控機制有較為深入的研究,而對於線粒體損傷情況下PINK1自身的調控尤其是其轉錄調控仍未完全闡明。
過往研究表明,線粒體損傷誘導的PINK1穩定主要依賴於其無法被線粒體內膜穿梭作用攝入,從而逃避MMP和PARL蛋白酶的切割作用,最終導致PINK1在線粒體外膜的累積。這一機制被認為是線粒體損傷條件下PINK1累積的主要原因。沈漢明研究團隊發現PINK1在線粒體損傷後的轉錄調控也是PINK1累積的關鍵原因,並通過生物資訊學分析將SMAD3識別為PINK1的潛在轉錄因子。進一步的實驗驗證表明,線粒體去極化能夠顯著促進SMAD3的磷酸化修飾及其核轉位,從而介導PINK1轉錄水準的上調,該調控過程獨立於經典TGFβ信號通路中的關鍵組分(如TGFβ-R1、SMAD2或SMAD4)。進一步研究發現,線粒體去極化誘導的PINK1啟動還參與其自身的轉錄調控:PINK1作為SMAD3的蛋白激酶,通過磷酸化修飾啟動SMAD3,從而促進PINK1的轉錄表達,形成一個正回饋環路,加速線粒體自噬的進程。
線粒體自噬是一種關鍵的細胞存活機制,通過清除受損線粒體來避免由線粒體損傷引發的細胞死亡。該研究揭示,SMAD3通過啟動PINK1的轉錄構建了一個抗凋亡信號通路,為細胞在應對線粒體損傷時提供了重要的生存機制。該研究揭示了SMAD3在PINK1轉錄調控中的新功能,發現了PINK1與SMAD3之間的相互正回饋調控機制,拓展了對SMAD3非經典生物學功能的認識,並闡明其在線粒體品質控制和細胞命運調控中的新功能,這種相互調控機制提高了線粒體自噬的效率。該研究為深入理解線粒體自噬的精細調控機制提供了新的研究視角,同時對闡明PINK1在帕金森病等神經退行性疾病中的病理功能具有重要的理論價值。
該研究的通訊作者為沈漢明,第一作者為澳大健康科學學院博士後唐名珠。澳大健康科學學院的博士生容達德、高向征和唐海梅,生物成像及幹細胞核心實驗中心,基因組學、生物信息學及單細胞分析核心實驗中心成員亦對研究做出重要的貢獻。該項目由澳門特別行政區科學技術發展基金(檔案編號:0078/2020/A2、0031/2021/A1、0081/2022/AMJ、0004/2021/AKP)和澳門大學(檔案編號:CPG2023-00032-FHS、MYRG2020-00022-FHS)資助。全文可瀏覽:https://www.nature.com/articles/s41421-025-00774-4。
| 新聞來源:健康科學學院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 88228004 |
| 梁曉珊 | 電話:(853) 88228009 |
| 電郵: | prs.media@um.edu.mo |